Н. Белковский, ЦЛИС, Г. Асс, А. Говерт, ВНИИ ВОДГЕО, Н. Барановский, МГМИ. — Рыбоводство, № 4, 1985, стр. 9-10.
Надежность и стабильность работы рыбоводных хозяйств в большой степени зависит от качества воды в источнике водоснабжения. Растворенные в воде вещества могут в сильной степени влиять на продуктивность водоемов и оказывают действие на физиологическое состояние рыб, особенно при увеличении плотности посадки и температуры воды.
Для поддержания необходимого уровня осмотически активных веществ в своем теле рыбы расходуют значительную энергию. Изменения солевого состава воды вынуждают рыб тратить дополнительную энергию на адаптацию и поддержание осмотического равновесия, что отрицательно сказывается на росте и оплате корма.
Рыбы способны усваивать из воды ионы натрия, калия, кальция, железа, серы, фосфора, двуокись углерода и многие другие элементы и соединения, необходимые для нормальной жизнедеятельности. Основное количество кальция проникает в организм рыб из воды через жабры, при этом до 94 % Ca может быть получено из воды (Сорвачев, 1982). Полагают, что для смешанных популяций рыб оптимальная жесткость воды — около 2 мг⋅экв/л (Ведемейер, Мейер, Смит, 1981)
При анализе показателей качества воды необходимо знать не только общую жесткость, но и соотношение ионов кальция и магния. Например, при содержании в воде кальция 30, 50 и 150 мг/л и постоянном уровне магния (13,5 мг/л) максимальный темп роста молоди осетра отмечался при концентрации кальция 50 мг/л (соотношение Ca:Mg=3,7:1). Изменение данного соотношения в любую сторону замедляло рост рыб (Богоявленская, 1959).
Определенный интерес представляют также данные о содержании в воде калия и натрия. Известно, что у животных деятельность нервной системы зависит от изменения проницаемости мембран нервных клеток для калия и натрия. От концентрации последних внутри и снаружи клетки зависит величина мембранного потенциала покоя и действия. Если калий рыба обычно в достаточном количестве получает с пищей, то содержание натрия в плазме крови у пресноводных видов рыб в значительной степени связано его концентрацией в источнике водоснабжения (Иванова, Лавриненко, 1981).
Ясно, что приведенные примеры далеко не исчерпывают всего многообразия связей физиологических процессов, протекающих в организме рыб, с солевым составом воды.
Анализ показателей качества воды источника водоснабжения с учетом современных данных по физиологии рыб — непременное условие при проектировании рыбоводных хозяйств и их эксплуатации. Вместе с тем даже в передовых хозяйствах нередко ограничиваются определением содержания растворенного в воде кислорода, pH, CO2 и гораздо реже исследуют ее солевой состав.
Оценивать качество воды должны на основании достоверных данных, объективно характеризующих гидрохимический режим. Обычно при выборе источника водоснабжения приходится использовать результаты анализов, выполненных разными организациями в разное время, а зачастую и различными химическими методами. При этом необходимо учитывать, что качество воды как поверхностных, так и подземных источников не остается постоянным. Например, в артезианских скважинах нередко по нескольку раз в году меняется содержание железа и сероводорода.
Следует отметить, что при пуске насоса артезианской скважины в работу железо, ранее отложившееся в призабойной зоне этой скважины, может перейти в воду.
Для того чтобы результаты анализа воды не носили случайный характер, необходимо перед отбором проб откачивать воду из артезианских скважин в течение более чем 24 ч.
Показатели качества воды поверхностных водоисточников зависят от количества выпавших осадков, режима водопользования, от естественных гидробиологических и физико-химических процессов. С учетом временной изменчивости (суточная, сезонная, межгодовая) гидрохимические показатели источника водоснабжения не должны выходить за допустимые пределы с вероятностью, например, 95 % для карповых и 99 % для форелевых хозяйств.
Концентрации веществ при гидрохимическом анализе обычно выражают в миллиграммах на литр (мг/л) или в миллимолях на литр (ммоль/л). Для проверки результатов химических анализов их приходится пересчитывать в концентрацию, выраженную в миллиграмм-эквивалентах (мг⋅экв/л), используя для этого коэффициенты пересчета, имеющиеся, например, в таких руководствах, как «Практическое руководство по гидрохимии» Н.С. Строганова и Н.С. Бузиновой, (М., 1980).
Проверять результаты анализа начинают с того, что подсчитывают сумму катионов и сумму анионов, которые должны быть равны между собой. Однако в виду того, что содержание в воде Na+ и K+ из-за относительно сложной техники анализа обычно не определяется, их концентрацию находят то разности сумм анионов и катионов. Следовательно, проверка равенства сумм анионов и катионов является недостаточной.
Общая жесткость воды (Жобщ мг⋅экв/л), определяемая аналитически, должна равняться сумме аналитически определяемого содержания кальция и магния:
Если Жобщ больше щелочности (Щ мг⋅экв/л), то
где
Жк — карбонатная жесткость.
В том случае, когда Жобщ меньше или равна Щ, то
Жк = Жобщ и Жнк = О,
где Жнк — некарбонатная жесткость анализируемой воды.
Проверить результаты анализа можно сравнением экспериментально определенной и рассчитанной по формуле величине сухого остатка.
Экспериментально определенный сухой остаток получается при выпаривании определенного объема воды, предварительно профильтрованной через бумажный фильтр, с последующим высушиванием осадка до постоянного веса при температуре 105 °C.
При выпаривании сухого остатка бикарбонатный ион разлагается согласно следующей реакции:
2 HCO3– = CO32– + H2O + CO2
В соответствии с этой реакцией величина сухого остатка (СО) должна вычисляться по формуле:
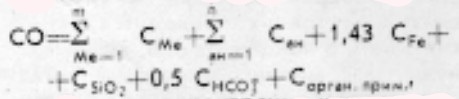
где
Cме — концентрация каждого из катионов (за исключением Fe), мг/л;
Cан — концентрация каждого из анионов (за исключением SiO2, HCO3–);
CFe — общее содержание железа (Fe2+ + Fe3+). Если концентрация железа в результатах анализа дана в виде Fe2О3, то этой величиной в мг/л заменяют слагаемое 1,43 CFe;
CSiO2 — концентрация кремнекислоты , мг/л
CHCO3 — концентрация ионов HCO3–, мг/л.
Величина определенного экспериментально сухого остатка должна приблизительно равняться вычисленной по формуле и превышать величину прокаленного осадка. Этот показатель (масса вещества, оставшаяся после прокаливания сухого остатка при температуре 600 °C) показывает содержание в воде минеральных веществ. При прокаливании происходит сгорание органических веществ, удаляются кристаллизованная года и двуокись углерода согласно реакциям
2 HCO3– → CO2– + 2 CO2↑ + H2O
CaCO3 → CO2 + CaO
В прокаленном остатке содержатся также и недиссоциированные неорганические вещества SiO2, Fe2O3, обычно присутствующие в природных водах.
Величина прокаленного осадка (ПО) может быть вычислена с учетом изложенного по следующей формуле:
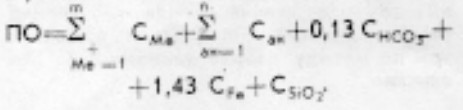
Величина экспериментально определенного прокаленного остатка должна приближенно равняться вычисленной по формуле.
Разница между сухим и прокаленным остатком характеризует содержание в воде органических веществ и в определенной степени коррелирует с окисляемостью и биохимическим потреблением кислорода (БПК).
Как уже отмечалось ранее, содержание K+ Na+ плюс в природных водах может представлять определенный интерес как для рыбоводов, так и для физиологов. Определение концентрации в воде калия и натрия может быть приближенно рассчитано с помощью следующего уравнения:
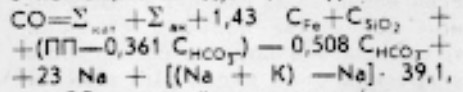
где
СО — сухой остаток, мг/л;
Σкат — концентрация катионов (за исключением K+, Na+ и Fe), мг/л;
Σан — концентрация анионов (за исключением SiO2, HCO3–)
CFe — общее содержание железа, мг/л. Если концентрация окисного железа в результатах анализа дана в виде Fe2O3, то этой величиной заменяют слагаемое 1,43 CFe;
CSiO2 — концентрация кремнекислоты, мг/л;
CHCO3– — концентрация бикарбонатов, мг/л;
ПП — потери при прокаливании сухого остатка, мг/л;
0,508 — доля снижения веса бикарбонатов при определении сухого остатка;
0,361 — доля снижения веса при прокаливании сухого остатка;
23 и 39,1 — эквивалентные веса соответственно натрия и калия;
ПП – 0,361 CHCO3– — органические примеси в сухом остатке, мг/л;
Na+K — суммарное содержание в воде калия и натрия, определенное по разности мг⋅экв/л.
Из предыдущего уравнения можно получить:
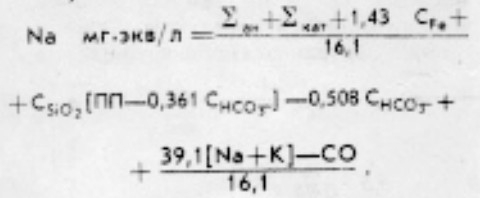
Далее определяется содержание калия:
K мг⋅экв/л = [Na+K]/Na
Для определения содержания свободного диоксида углерода по значению pH и щелочности воды можно воспользоваться номограммой.
![Номограмма для определения содержания в воде свободного диоксида углерода [CO<sub>2</sub>]<sub>св</sub> или pH Номограмма для определения содержания в воде свободного диоксида углерода [CO<sub>2</sub>]<sub>св</sub> или pH](/upload/medialibrary/94f/nomogramma.jpg)
Номограмма для определения содержания в воде свободного диоксида углерода [CO2]св или pH: pH — водородный показатель; P — общее солесодержание, г/л; Щ — общая щелочность, мг⋅экв/л; t — температура, °С; [CO2]св — содержание свободного диоксида углерода, мг/л. При определении [CO2]св отрезок между значениями pH и солесодержанием воды [l1] складывают с отрезком между значениями щелочности и температуры [l2]. Вправо от стрелки на нижней шкале отклладывают сумму [l1 + l2] и читают значение [CO2]св. При определении pH по известному [CO2]св из отрезка [l1 + l2] вычитают l1, полученный отрезок [l1] откладывают на верхней шкале влево от значения солесодержания и читают значение pH. Номограмма составлена А. А. Говертом по методу, разработанному Г. С. Хованским.
Оригинал статьи полностью в формате PDF:
Н. Белковский, ЦЛИС, Г. Асс, А. Говерт, ВНИИ ВОДГЕО, Н. Барановский, МГМИ. Анализ воды в источниках водоснабжения. — Рыбоводство, № 4, 1985, стр. 9-10.
